■ヒトiPS細胞から3次元的な心臓組織を作製し、致死性不整脈であるTdPの複雑な特徴を培養下に再現することに成功|京都大学iPS細胞研究所

参考画像:ヒトiPS細胞から3次元的な心臓組織を作製し、 致死性不整脈の複雑な特徴を培養下に再現することに成功(2017/10/23、京都大学iPS細胞研究所)|スクリーンショット
ヒトiPS細胞から3次元的な心臓組織を作製し、 致死性不整脈の複雑な特徴を培養下に再現することに成功
(2017/10/23、京都大学iPS細胞研究所)
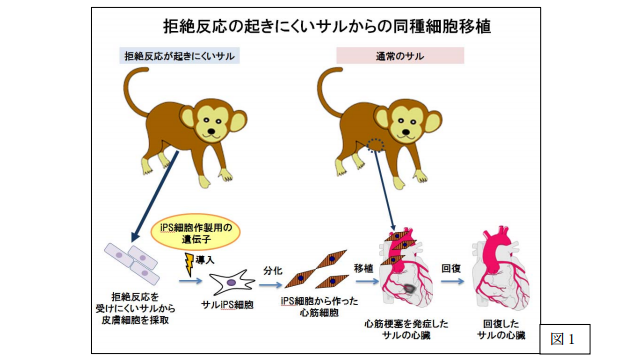
ヒトiPS細胞から分化誘導した心筋細胞および間葉系細胞注1を用いて3次元的な心臓組織を作製した。
同3次元心臓組織を使って、致死性不整脈であるトルサード・ド・ポアント(Torsade de Pointes: TdP)注2の複雑な特徴を培養下に再現することに初めて成功した。
これまで不可能であった不整脈の発生を培養下に再現・解析したことにより、新しい安全性薬理試験や創薬研究のほか、難治性不整脈の治療法開発への応用が期待される。
川東正英大学院生(京都大学CiRA増殖分化機構研究部門・京都大学大学院医学研究科心臓血管外科学)、山下潤教授らの研究グループは、ヒトiPS細胞由来の3次元的心臓組織を作製し、不整脈の一種であるトルサード・ド・ポアント(TdP)を培養下に再現することに成功しました。
このことにより、難治性不整脈の治療法開発への応用が期待されます。
■背景
TdPは心臓突然死の原因となる不整脈の一種で、薬の副作用としてしばしば現れることがあります。TdPが副作用として現れたために、薬の開発が中断されたり、既に上市された薬が市場から回収されたりすることもあります。そのため、開発の早い段階で薬の毒性を評価できるヒトの心臓のモデルが求められていました。
トルサード・ド・ポアント(Torsade de Pointes: TdP)が副作用として現れたために、薬の開発が中断されることが起こることがあり、薬の毒性を評価できるヒトの心臓のモデルが求められていたそうです。
■致死性不整脈
致死性不整脈とは何なのでしょうか?
不整脈 | 疾患別解説 | 心臓病の知識 | 公益財団法人 日本心臓財団
1)致死性不整脈
基礎疾患の有無に関わらず、放置すると短時間で死亡してしまう危険性の高い不整脈を「致死性不整脈」といいます。つまり、不整脈そのものの重症度が極めて高く、怖い不整脈の代表です。これらの不整脈が発生したら一分一秒を争って治療しなければ、悲惨な結果を招く可能性が高くなります。
頻脈性不整脈:心室細動、持続性心室頻拍、トルサード・ド・ポワンツ
徐脈性不整脈:房室ブロック、洞不全症候群
不整脈には、放置していると短時間で死亡してしまうリスクの高い不整脈(致死性不整脈)、長時間放置すると死亡することもある不整脈(準致死性不整脈)などがあるそうです。
その中でも、致死性不整脈は、重症度が極めて高い不整脈です。
■怖い不整脈とは?
不整脈とは|不整脈の症状・原因・判断する基準の脈拍によれば、不整脈とは、心臓のリズムが乱れ、脈の打ち方がおかしくなってしまうことをいいます。
心臓は、「洞結節(心臓の上の方に位置する)」で電気が作られ、「伝導路(電気の通り道)」を通り、心臓全体に流れ、筋肉が収縮して動いています。
不整脈は、この心臓の動く仕組みに何らかの問題(例えば、洞結節で電気が作られない、伝導路をうまく伝わらない)が起こることによって、心臓が規則正しく動かなくなってしまいます。
では、どのようなことが原因となって不整脈が起きるのでしょうか。
心臓の病気というと、心筋梗塞を思い出す人もいると思いますが、心筋梗塞は心臓の血管が詰まって起きる病気であるのに対して、不整脈は、わかりやすく言えば、電気系統の問題であって、同じ心臓病とはいっても、全く違う病気です。
国立循環器病研究センターによれば、怖い不整脈の症状として3つの例が挙げられています。
怖い不整脈と怖くない不整脈|国立循環器病研究センター
「何もしていないのにふうっとする」「急に意識がなくなる。つまり失神する」
失神症状が出ている場合には、心臓が止まっていたり、頻脈(脈が速くなる)が起きている可能性があるそうです。
「脈拍数が1分間40以下で、体を動かす時に、強い息切れを感じる」
心臓で電気が作られなかったり、途中で止まったりすることで徐脈(脈が遅くなる)が起こります。
「脈拍数が1分間に120以上で、突然始まり、突然止まる」、または「まったく不規則に打つ」
突然動悸が始まる場合には、病的な頻脈を起こしていることが考えられます。
■まとめ
最近は、患者などに頼ることなく薬の効能・効果や毒性を評価でき、また前臨床試験で行われている動物実験の問題点を克服できることを目的とした、「Human/Organ on a Chip」や生体臓器に極めて近似した立体臓器に対する副作用を評価できるモノが研究されています。
医薬品開発においては、薬効や副作用を確かめる必要があり、そのために、マウスやラット、サルなどの実験動物を用いて、薬効や毒性を調べる全臨床試験を行なわれています。
しかし、これらの動物はヒトと異なる生体構造・生理反応機構を持っているので、医薬品がヒトとは異なる反応を示すことがあり、また、動物実験が動物虐待に当たるのではないかという批判から化粧品メーカーによる動物実験が世界的に廃止の流れを受けて、今後医療分野においても廃止の流れになる可能性があります。
そこで、ヒトの生理学反応を生体外で再現する試験法の開発が求められている中で注目されているのが、「Organ on a Chip」です。
どんなに医療が進んでも難しいのはヒトに対して使用できるまでの時間が必要なこと。
安全性を確保するうえで大変重要なことですが、目の前に救いたい患者がいて、治るかもしれない治療法が生まれていたとしても、その安全性を高めていくためには時間がかかってしまいます。
また、どんなにAIの性能が向上し、何度もシミュレーションをして安全性を高められたとしても、やはり人間(人間に近い臓器)でどのような反応を示すかがやはり重要です。
今回の研究のように、ヒトiPS細胞由来の3次元的心臓組織を作製し、不整脈の一種であるトルサード・ド・ポアント(TdP)を培養下に再現して、薬の毒性を評価することができるものができれば、より早く患者のもとへ薬を届けることにつながっていくことが期待されます。
【参考リンク】
続きを読む ヒトiPS細胞から3次元的な心臓組織を作製し、致死性不整脈であるTdPの複雑な特徴を培養下に再現することに成功|京都大学iPS細胞研究所