■筋萎縮性側索硬化症(ALS)の細胞死を引き起こすメカニズムを解明|活性化カルパインが核膜孔複合体構成因子を切断し、核-細胞質輸送を障害|東大
参考画像:筋萎縮性側索硬化症(ALS)の細胞死を引き起こすメカニズムを更に解明-活性化カルパインが核膜孔複合体構成因子を切断し、核-細胞質輸送を障害- (2017/1/3、東京大学プレスリリース)|スクリーンショット
筋萎縮性側索硬化症(ALS)の細胞死を引き起こすメカニズムを更に解明-活性化カルパインが核膜孔複合体構成因子を切断し、核-細胞質輸送を障害-
(2017/1/3、東京大学プレスリリース)
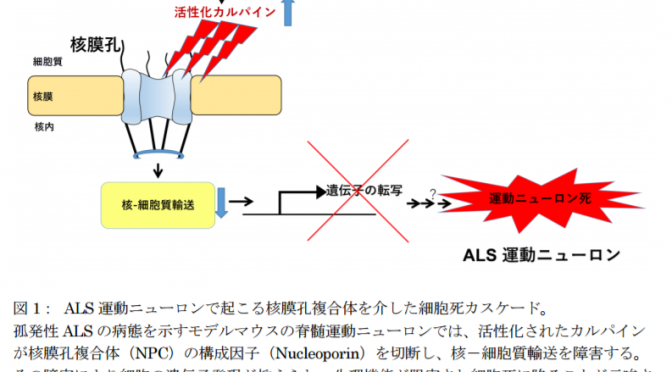
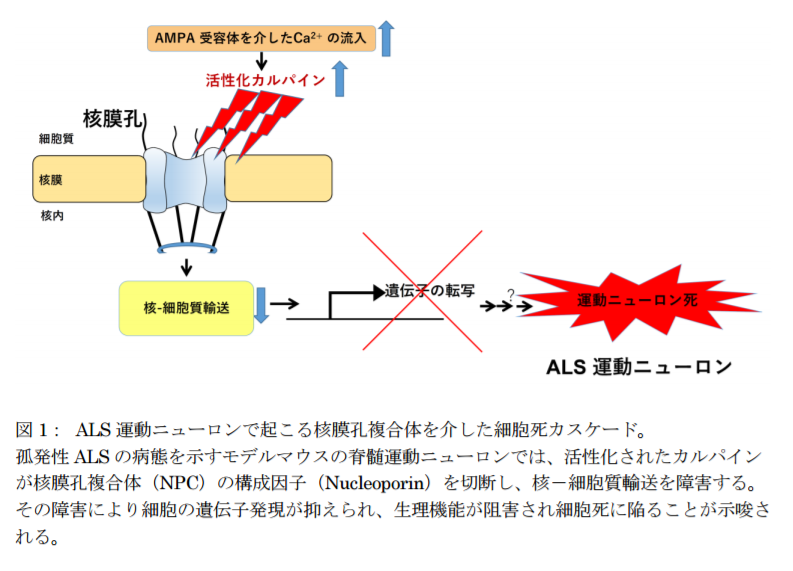
本研究グループは、ALS の病因解明研究を進めるなかで、異常なカルシウム透過性 AMPA受容体(注4)が発現していることが病因に関わる疾患特異的分子異常であり、細胞内カルシウム濃度の異常な上昇がカルパインの活性化を通じて ALS 運動ニューロンに特異的に観られる TDP-43 病理を引き起こすことを既に明らかにしていました。今回、カルパインの活性化がNPC の構成因子であるヌクレオポリンを異常に切断することで、核-細胞質輸送を障害することを解明しました。この障害は運動ニューロンでの必要な遺伝子発現を抑えるので、細胞の生理活動が阻害され細胞死に陥ることが考えられます。
国際医療福祉大学臨床医学研究センター郭伸特任教授(東京大学大学院医学系研究科)、山下雄也特任研究員(東京大学大学院医学系研究科)らの研究グループは、東京医科大学相澤仁志教授との共同研究で、カルパイン(細胞に広く発現しているカルシウムにより活性化するタンパク分解酵素)の活性化が核膜孔複合体(Nuclear Pore Complex;NPC)の構成因子であるヌクレオポリンを異常に切断しすることで、核と細胞質輸送が障害され、細胞死を引き起こすメカニズムを解明しました。
この障害が運動ニューロンでの必要な遺伝子発現を抑えるので、筋萎縮性側索硬化症(ALS)の原因メカニズムであることが明らかになりました。
【関連記事】