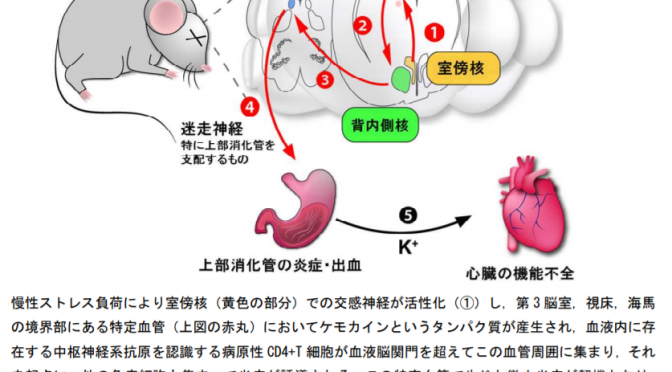
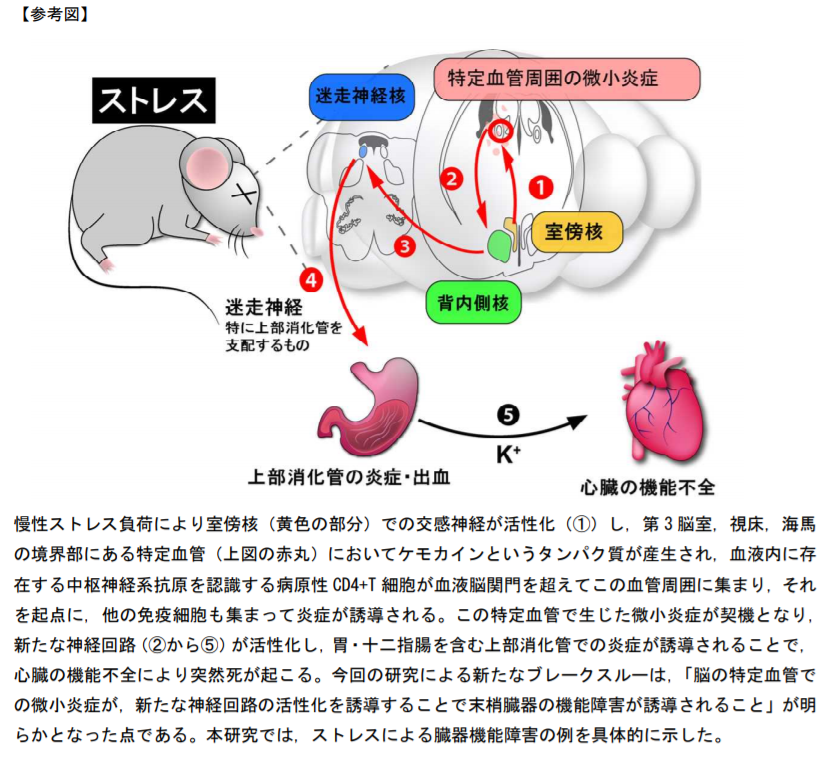
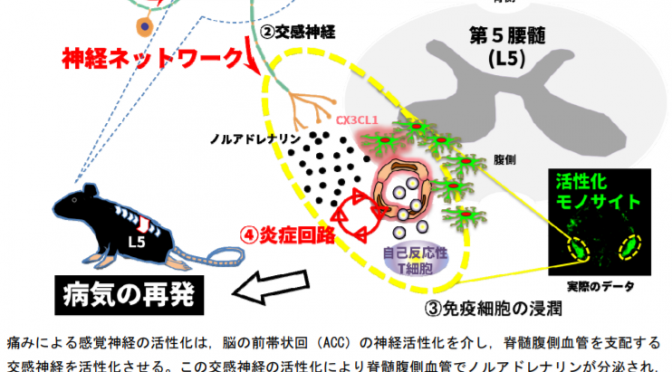
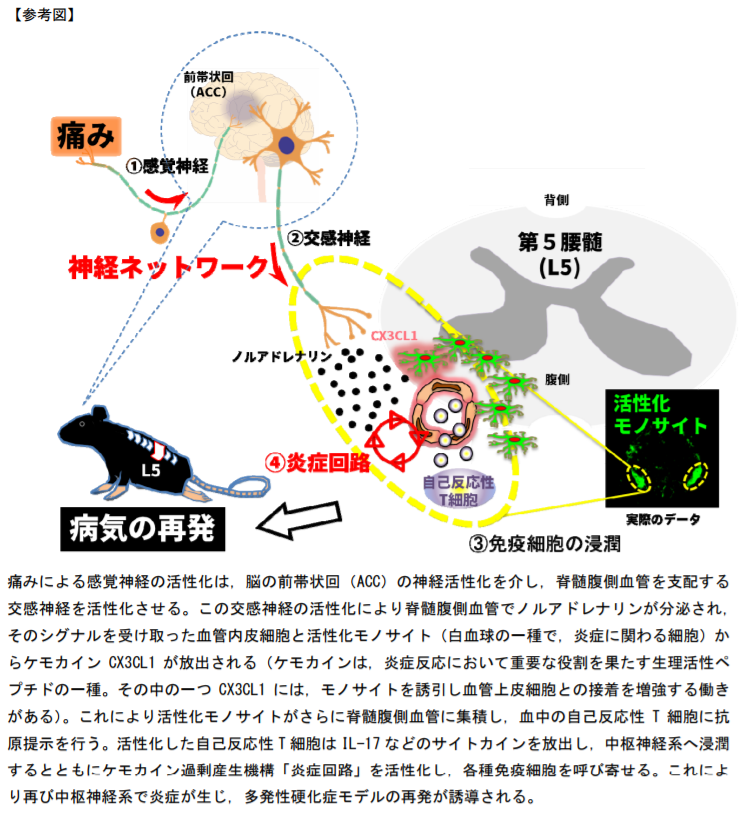
■iPS細胞から血小板量産する技術確立
by 从峰 陈(画像:Creative Commons)
(2017/8/7、日本経済新聞)
大学発ベンチャーのメガカリオンの事業に国内企業16社が協力し、iPS細胞から血小板を量産する技術を確立したそうです。
この研究のどの点がすごいのかは、この研究の背景を見てみるとわかります。
■血小板とは?血小板の持つ役割
(2014/2/14、CiRA)
血小板は止血に重要な役割を果たす血液細胞で、巨核球という細胞から分離することで生み出され、血液の中を循環しながら、止血で利用されるか一定の寿命で崩壊します。自ら分裂することはできないので、常に巨核球から作られ、必要量が補充されています。現在、深刻な貧血および出血素因をもたらすような血液疾患の患者さんは、献血による血液製剤を用いた輸血に頼らざるを得ない状況です。
iPS細胞技術を基盤とする血小板製剤の開発と臨床研究|JST
更に、繰り返し輸血が必要な慢性血小板減少症の患者さんの多くは、ご自身と同じ血液型(例:HLA{ヒト白血球抗原] HPA[ヒト血小板抗原])の血小板を輸血する事が必須です。
血小板には止血をする重要な機能を持っていますが、血小板は細胞核がなく増殖しない機能細胞であるため、常に巨核球から作られ、必要な量が補充されています。
■背景
(2014/2/14、CiRA)
しかし、献血ドナーの数は少子高齢化等もあり、減少しています。厚生労働省の統計によると、2027年には我が国の必要な輸血製剤の20%はドナー不足に伴い供給できないと発表されています。
特に血小板は機能を維持するために室温で保存する必要があり、採血後4日間しか有効期間がありません。
ポイントは2つ。
●献血ドナーの減少
●血小板の機能を維持するためには室温で保存する必要があり、採血後4日間しか使うことができない
2027年には延べ約85万人分の血液が不足すると推計|日本赤十字社シミュレーションによれば、献血からつくられる輸血用血液にはいくつか種類があります。
・出血防止に必要な血中の要素を取り出した「血漿(けっしょう)製剤」は採血後1年間もつ
・外科手術の出血時などに用いられる「赤血球製剤」は採血後21日間
・止血機能をもつ「血小板製剤」は採血後4日間
血小板の性質上、長期間の保管はできないため、現在は献血に依存しているのですが、少子高齢化の影響もあり、献血ドナーが不足することが予想されています。
少子高齢化は「献血」にも影響を与えている(2012/1/4)で取り上げましたが、東京都の年代別輸血状況調査によると、輸血用血液製剤の約85%は50歳以上の方々に使われているのですが、献血をしている人の年齢層を見ると約78%が50歳未満(その内の約27%が16-29歳)と、健康な若い世代が高齢者医療の多くを支えている現状があり、今後、少子高齢化が進み、現在の献血者比率がこのまま推移していくと、血液が不足するという事態が起こるかもしれないそうです。
そこで考えられたのが、iPS細胞から血小板を生産するというアイデアです。
(2014/2/14、CiRA)
江藤教授らのグループは2010年に皮膚細胞由来のiPS細胞から培養皿上で血小板が生産できることを発表しました。しかし1回の輸血では患者さん1人につき2000~3000億個もの血小板が必要ですが、これまでの方法では、10億個程度しか生産できませんでした。そこで今回は血小板前駆細胞である巨核球に着目し、長期間にわたって自己複製することができる巨核球の誘導を試みました。
中村壮研究員(京都大学CiRA)、江藤浩之教授(京都大学CiRA)らの研究グループは、ヒトiPS細胞から自己複製が可能な巨核球を誘導することに成功し、大量に血小板を生産する方法を確立しました。
※iPS細胞を使って血小板を作る仕組みは基幹技術|メガカリオンを参考にしてください。
簡単にまとめると、iPS細胞から作られた造血前駆細胞に細胞を増やす遺伝子と老化を防ぐ遺伝子、細胞死を防ぐ遺伝子の3つの遺伝子を導入することで、巨核球のもととなる巨核球前駆細胞を作ります。
血小板は常温で4日間と保存期間が短いという性質を持ちますが、巨核球前駆細胞は冷凍することにより長期保存ができるため、必要に応じて提供することが可能になります。
このアイデアの素晴らしい点はもう一つあります。
iPS細胞技術を基盤とする血小板製剤の開発と臨床研究|JST
血小板輸血不応症患者さんは、HLA/HPAが一致する登録済みのドナーさんから輸血用血小板を供給してもらう必要があります。しかし、その安定供給は非常に困難です。
血小板産生前駆細胞である“巨核球”を凍結保存が可能な細胞株として, 患者さん自身あるいはドナー由来のiPS細胞から作製します。この巨核球細胞株は品質が一定であれば将来にわたって必要な血小板を供給する為のソースになり得ます。
血小板輸血不応症患者さんは、自身と同じ血液型(例:HLA/HPAの血小板を輸血すること)のドナーからの輸血用血小板を供給してもらう必要があるのですが、iPS細胞から血小板を量産する技術を確立することができれば、患者さん自身やドナー由来のiPS細胞から作製することにより、将来にわたって必要な血小板を供給することができるようになります。
■まとめ
iPS細胞から血小板を量産する技術を確立したというニュースを見ても、自分とは関係ない遠い話のように感じます。
しかし、少子高齢化社会の日本においては、献血ドナーの減少に伴って、輸血用血液が不足することが予想されています。
iPS細胞から血小板を量産する技術というのは、実は私たちの身近な問題を解決する重要な技術だったのです。
【参考リンク】
続きを読む iPS細胞から血小板量産する技術確立|血小板とは?血小板の持つ役割・血小板量産する技術のすごいところとは?