> 健康・美容チェック > 肝臓 > ミニ肝臓のヒト肝細胞は生体内の肝細胞により近い状態に分化することを確認|横浜市立大学
■ミニ肝臓のヒト肝細胞は生体内の肝細胞により近い状態に分化することを確認|横浜市立大学
by U.S. Army RDECOM(画像:Creative Commons)
(2017/6/15、横浜市立大学・科学技術振興機構)
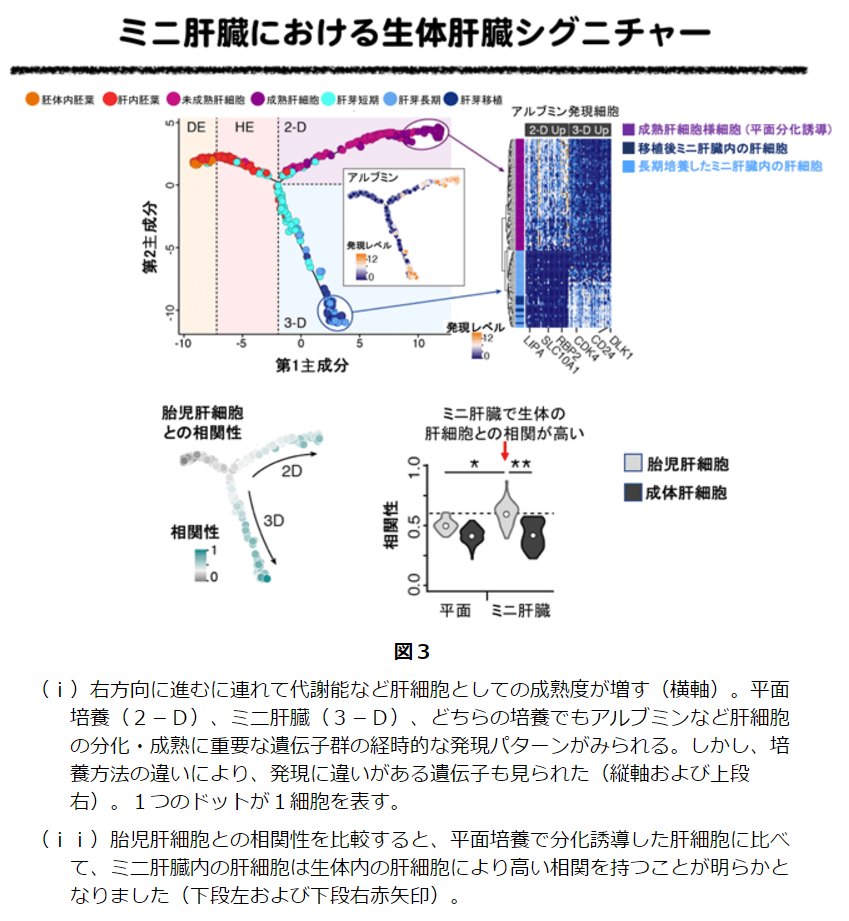
生体内のヒト肝細胞、平面培養したヒト肝細胞、ミニ肝臓内のヒト肝細胞を比較したところ、平面培養で分化誘導した肝細胞に比べて、ミニ肝臓内の肝細胞は生体内の肝細胞により高い相関を持つことが明らかとなりました。これが、平面培養した肝細胞に比べ、ミニ肝臓の方が肝障害に対する高い治療効果が得られることの理由のひとつではないかと考えられます。
横浜市立大学の関根圭輔助教、武部貴則准教授、谷口英樹教授らの研究グループは、ドイツ・マックスプランク研究所のBarbara Treutlein、シンシナティ小児病院と共同で行なった研究によれば、ミニ肝臓の肝細胞は、平面培養により分化誘導した肝細胞に比べて、生体内のヒト肝細胞により近い状態に分化することがわかり、このことがミニ肝臓が肝障害に高い治療効果が得られる理由の一つであると考えられるそうです。
参考画像:iPS細胞を用いてヒト肝臓発生の複雑なメカニズムを解明(2017/6/15、横浜市立大学・科学技術振興機構)|スクリーンショット
■まとめ|ミニ肝臓とは?
ミニ肝臓とは、どういうものでしょうか?
(2017/6/15、横浜市立大学)
ヒトiPS細胞から分化誘導した肝内胚葉細胞と、血管内皮細胞、間葉系細胞を最適な比率で混ぜ合わせることで、in vitro培養条件下で自律的に創出した肝臓の基となる立体的な肝芽(ミニ肝臓)のこと(Nature 499(7459): 481-4, 2013; Nature Protocol 9(2): 396-409, 2014)。さらに、この革新的な3次元培養技術(器官原基法)を他器官の作製に応用し、肝臓のみならず、膵臓、腎臓、腸、肺、心臓、脳から分離した細胞から3次元的な器官原基を創出することを報告している。創出された3次元器官原基は、移植後すみやかに血流を有する血管網を再構成し、機能的な組織を自律的に形成することができる(Cell Stem Cell. 16(5): 556-65, 2015)。
(2015/2/3、東洋経済オンライン)
iPS細胞から肝細胞になる手前の前駆細胞を作り、そこへ血管のもととなる内皮細胞、接着剤の役割を担う間葉系細胞の2種類の細胞を混ぜて培養。すると、すべての細胞が48~72時間でボール状に集まってきた。これが網目状の血管構造を持つミニ肝臓だ。
今回の研究によって、ミニ肝臓の作製技術は、再生医療にとっての重要な技術であることが有効であることがわかっただけでなく、臓器の発生プロセスを解明するツールになることが期待されます。
【関連記事】
- HLAホモドナーiPS細胞からミニ肝臓作製に必要な3種類の全ての細胞の作製に成功|#横浜市立大学
- IPS細胞から「ミニ肝臓」を大量に作り出す装置を開発|横浜市立大学(2015/2/19)
- 世界初!IPS細胞から“ミニ肝臓”作製に成功!(谷口英樹さん)|夢の扉+
- 肝臓の細胞は100個集まっても組織的に働かないが、1000個集まれば肝臓の役割を発
揮する|東大の研究グループが解明