【目次】
■微量血液でアルツハイマー病を早期診断|国立長寿医療研究センター、島津製作所のノーベル賞・田中耕一さんらと開発

by National Eye Institute(画像:Creative Commons)
アルツハイマー、血液で早期検査=治療薬開発に貢献へ―長寿医療研など
(2018/2/1、時事通信)
研究グループは、アミロイドベータに関連し、脳から血液中にわずかに漏れ出した3種類の物質を調べ、異常な蓄積の有無を判断する方法を確立した。この方法で日本とオーストラリアの計232人を調べたところ、PETの結果と9割が一致した。
検査する物質3種類のうち1種類は脳に蓄積しやすいため、異常な蓄積が起きると血中に出る量が減る。他の2種類は蓄積しにくく、血中の量はあまり変わらない。これらの比率を調べ、異常な蓄積の有無を判断する。
国立長寿医療研究センターと島津製作所などの研究グループによれば、アルツハイマー病の原因とされる物質を早い時期に血液を使って検査する方法を開発したそうです。
以前、血液検査で認知症の兆候を精度80%で識別することに成功―筑波大など(2015/6/29)によれば、内田和彦筑波大学医学医療系准教授らのグループが正常な認知機能と、認知症予備軍とされる軽度認知障害(MCI)を血液検査でバイオマーカーを使って識別できる方法の第一歩となる技術を開発したと紹介しましたが、アルツハイマー病の早期発見に向けての研究が進んでいるようですね。
研究グループによると、アルツハイマー病患者の脳には、認知症が現れる20年以上前から異常なたんぱく質「アミロイドベータ」が蓄積され始める。蓄積を検出するには陽電子放射断層撮影(PET)などが必要だが、高額の費用などが問題だった。
これまでにもアミロイドβとアルツハイマー型認知症の関係について取り上げてきました。
しかし、アミロイドβの蓄積がアルツハイマー病の原因の一つと考えられていても、その蓄積を検出するには陽電子放射断層撮影(PET)などが必要だったのですが、高額の費用など問題がありました。
今回の研究では、脳から血液中に出た3種類の物質を調べ、一種類は脳に蓄積しやすく、他の2種類は蓄積しにくいということを基に、これらの比率を調べ、異常な蓄積の有無を判断したところ、PETの結果と9割が一致することがわかったことから、アルツハイマー病を早期発見する方法に一歩近づいたといえるようです。
■質量分析が医療研究に欠かせない!
田中耕一さんの技術、アルツハイマー早期診断への道開く
(2018/2/1、朝日新聞)
今回開発された手法は、2002年にノーベル化学賞を受賞した田中耕一さんの技術を活用し、代表的な認知症であるアルツハイマー病を「超早期に診断」する技術につながる。
ノーベル賞と質量分析 10の質問|島津製作所
2002年のノーベル化学賞は、タンパク質などの生体高分子を調べる技術に焦点が当てられました。そして、田中さんの受賞理由は、質量分析のための「ソフトレーザー脱離イオン化法」を開発したことです。田中さんを含む5人の研究チームが、1985年2月に、それまで不可能とされていた、「タンパク質を壊さないでイオン化すること」に世界で初めて成功しました。つまり、質量分析でタンパク質を研究する道を開いたのです。その後、多くの研究者の努力によりその技術が発展して、今では病気の診断や薬の開発になくてはならない技術となりました。
タンパク質の構造のわずかな違いが病気を引き起こすことがあります。ですから、からだの中のタンパク質を調べることによりかなりの病気の診断ができます。最近では、質量分析で細胞や血液の中のタンパク質を調べることにより、「がん」の早期発見もできるようになってきました。
今回の研究では血液中のたんぱく質を調べることにより、アルツハイマー病を早期発見することを目指す研究ですが、その研究も2002年のノーベル化学賞を受賞した田中耕一さんの質量分析でたんぱく質を研究するということがわからなければ、現在の研究には至っていないわけですから、すごいことですよね。
この記事を読むと、質量分析は医療の研究にとって欠かせないものとなっていますが、以前日経デジタルヘルスが行なった田中耕一さんへのインタビューを読むと、そうでなかったことを知り、さらに驚かされます。
機は熟した、今こそ医療に飛び込もう 田中 耕一氏 島津製作所 フェロー 田中最先端研究所 所長
(2012/3/15、日経デジタルヘルス)
電子の性質を利用する技術であるエレクトロニクス技術が進歩したことによって、より高精度に、高感度に観察することができるようになり、それを医療に活かすことによって信頼性を高めることにつながっているそうです。
■病気の超早期発見がキーワード
そして、2012年のインタビューで今回の研究にもつながるキーワードが挙げられています。
ターゲットとなるキーワードは、やはり病気の超早期発見です。
病気の超早期発見によって、生活習慣を少し改善したりするだけで治る可能性があり、そしてそのことは医療費の削減にもつながることが期待されます。
さらに、遺伝子情報などをベースにした個別化医療(テーラーメイド医療)に注目が集まり始めています。
【未来予測】遺伝子検査+健康・医学関連情報を詳しく書き込んだ家系図を作る方法で自分自身の健康を守る|#遺伝子は変えられる
遺伝的に特定の病気になりやすい体質、よくいわれるのが、家族歴とかある病気になりやすい家系というものは存在していて、そうした遺伝情報がゲノムに書かれており、ゲノムを解析することによって病気の原因を知ったり、私たち一人一人の体質にあったオーダーメードの医療・治療法を選んでいくことを「ゲノム医療」と呼ぶそうですが、こうした分野での活躍も期待されます。
■まとめ
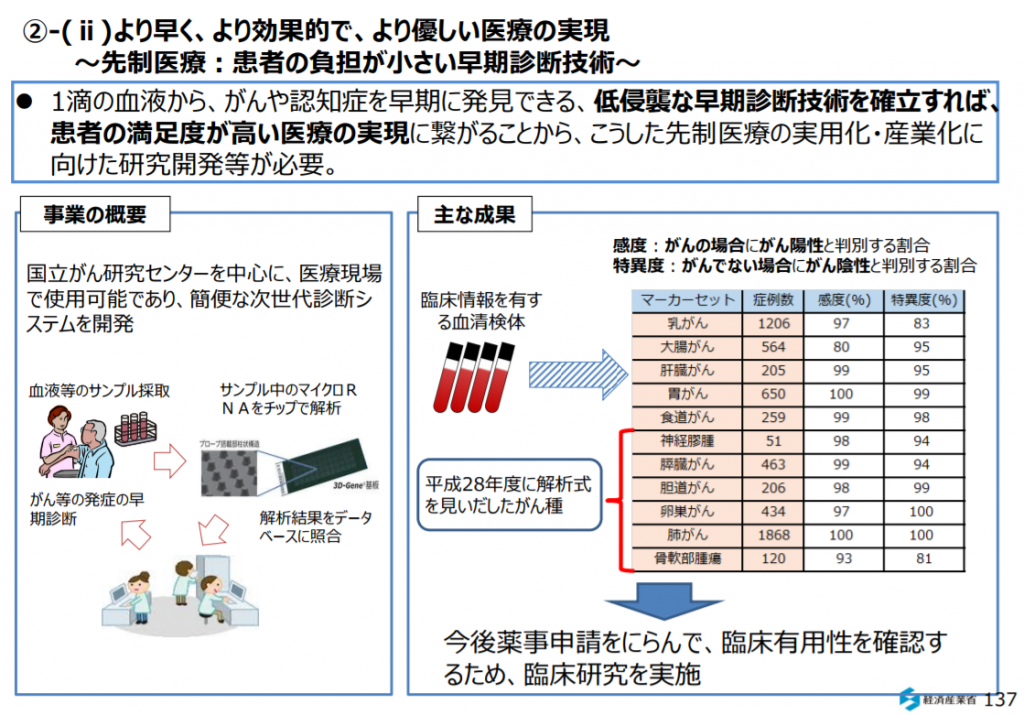 一滴の血液から、がんや認知症を早期に発見できる、低侵襲な早期診断技術を確立すれば、患者の満足度が高い医療の実現につながることから、こうした先制医療の実用化・産業化に向けた研究開発等が必要。
一滴の血液から、がんや認知症を早期に発見できる、低侵襲な早期診断技術を確立すれば、患者の満足度が高い医療の実現につながることから、こうした先制医療の実用化・産業化に向けた研究開発等が必要。
参考画像:新産業構造ビジョン(2017/5/30、経済産業省)
新産業構造ビジョン(2017/5/30、経済産業省)によれば、患者のQOLの最⼤化に向けて、個⼈の健康・医療データを活かす新たなシステムが必要であるとして、患者⾃らが納得して選択できる医療、患者の満⾜度の⾼い医療、時間・場所を問わず、必要な医療が提供される環境の実現が必要とあり、その中でも、より早く、より効果的で、より優しい医療の実現に資する、先制・個別化・再⽣医療等の先進医療や、先端技術を⽤いた医療機器の開発等取り組みが重要となるとあります。
その一つが、今回取り上げた、血液一滴から病気を早期発見できる診断技術です。
新産業構造ビジョン(2017/5/30、経済産業省)によれば、1滴の⾎液から、がんや認知症を早期に発⾒できる、低侵襲な早期診断技術を確⽴すれば、患者の満⾜度が⾼い医療の実現につながることから、こうした先制医療の実⽤化・産業化に向けた研究開発等が必要とあります。
今後ますます「先制医療」への注目が集まるのではないでしょうか?
【アミロイドβ 関連記事】
続きを読む 微量血液でアルツハイマー病を早期診断|国立長寿医療研究センター、島津製作所のノーベル賞・田中耕一さんらと開発 →